Азотистая кислота HNO2, слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли А.к. называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны.
В газовой фазе планарная молекула А.к. существует в виде двух конфигураций цис- и транс-. При комнатной температуре преобладает транс-изомер.
Вторая структура является более устойчивой. Так, для цис-HNO2(г) DG°f = -42,59 кДж/моль, а для транс–HNO2(г) DG = -44,65 кДж/моль.
В водных растворах существует равновесие:
2HNO2 ↔ N2O3 + H2O ↔ NO↑ + NO2↑ + H2O
При нагревании раствора А.к. распадается с выделением NO и NO2:
3HNO2 ↔ HNO3 + 2NO↑ + H2O.
HNO2 в водных растворах диссоциирует (KD=4,6×10−4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
H2SO4 + NaNO2 → NaHSO4 + HNO2.
А.к. проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (Н2О2, KMnO4) окисляется в HNO3:
2HNO2 + 2HI → 2NO↑ + I2↓ + 2H2O;
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O;
HNO2 + Cl2 + H2O → HNO3 + 2HCl.
А.к. можно получить при растворении оксида азота (III) N2O3 в воде:
![]()
Также она получается при растворении в воде оксида азота (IV) NO2:
![]()
Применяется для диазотирования первичных ароматических аминов и образования солей диазония. Нитриты применяются в органическом синтезе при производстве органических красителей.
А.к. токсична, причём обладает ярко выраженным мутагенным действием, поскольку является деаминирующим агентом.
АЗОТИСТАЯ КИСЛОТА, HNO2— одноосновная нестойкая слабая кислота. Описана в 1774 Шееле; физические свойства систем, содержащих А. к., изучал в 1900 А. В. Сапожников. А. к. известна лишь в разбавленных водных растворах; при попытке удалить из них воду А. к. распадается по реакции: 31ШОа = HNO:, + 2NO + П.,0. Известен ангидрид А. к. JN203. А. к. может- быть либо окислителем, либо восстановителем, в зависимости от реагирующих с нею веществ. Напр., в кислом растпоре она окисляет J' до г2 и восстанавливает Мп()'4 до Ми'-. Соли А. к. называются азотистокнельши (нитритами). Они получаются нагреванием солей азотной кислоты со свинцом, пап p. i\aN03 -f-Pb — РЬО-|-+NaN02. Соли А. к. широко применяются в органическом синтезе.
Азотистая кислота, HNO2, одноосновная, нестойкая, довольно слабая кислота, существующая только в разбавленных холодных водных растворах. Структурная формула HO—N = О. Константа диссоциации А. к. 4,5×10-4 при 18°C. Образуется наряду с азотной кислотой при растворении NO2 в воде: 2NO2 + H2O = HNO2 + HNO3. При нагревании и действии сильных кислот или окислителей А. к. разлагается с образованием окиси азота: 3HNO2 = HNO3 + 2NO + H2O. Восстановлением А. к. могут быть получены N2O,NO, NH2OH, NH3 и др. Соли А. к. (нитриты) получают восстановлением нитратов. Наиболее важное свойство А. к .— способность к диазотированию ароматических аминов. Поэтому в производстве азокрасителей широко применяют натрия нитрит NaNO2; при действии на эту соль кислот образуется свободная А. к.:
NaNO2+HCI = NaCI+HNO2.
А. к. и её соли при попадании внутрь ядовиты. Профессиональные отравления редки. Нитрит натрия применяют в медицине при стенокардии и спазмах сосудов головного мозга.
АЗОТИСТАЯ КИСЛОТА HNO2,
бесцв. в-во, существующее в виде паров или
водного р-ра. Нагревание паров или
их конденсация, а такжеконцентрирование водных
р-ров приводят к разложению азотистой кислоты:
в парах-по р-ции 2HNO2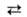 NO
+ NO2 + Н2О, в p-pe-3HNO2
NO
+ NO2 + Н2О, в p-pe-3HNO2![]()
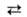 HNO3 +
2NO + Н2О. Сильные неорг. к-ты катализируют
разложение. Азотистая кислота существует
в двух таутомерных формах:
HNO3 +
2NO + Н2О. Сильные неорг. к-ты катализируют
разложение. Азотистая кислота существует
в двух таутомерных формах: 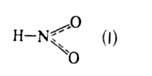
и НО—N=O (II), для каждой из к-рых известны
свои ряды комплексных соед. и орг.
производных, содержащих соотв. нитрогруппу
NO2 и нитритогруппу ONO. При 298 К равновесная
смесь содержит 0,309 мольных долей I и
0,691 мольных долей П. Для газообразных I
и II С°р соотв. 45,4 и 46,0 Дж/(моль*К);![]() H°обр -77,4
и -79,5 кДж/моль,
H°обр -77,4
и -79,5 кДж/моль,![]() G°обр -42,6
и -44,6кДж/моль; S°298 249 Дж/(моль*К).
G°обр -42,6
и -44,6кДж/моль; S°298 249 Дж/(моль*К).
Азотистая кислота - одноосновная к-та средней силы; при 12,5°С рКа 3,37, степень диссоциации в 0,1 н. водном р-ре 6,5%. С основаниями образует соли-нитриты. Сильными окислителями (Н2О2, КМпО4 и др.) окисляется до HNO3. Восстанавливается до NO (под действием HI и др.), H2N2O2 (под действием NH2OH) или до смеси NO + N2O + + H2N202.
Получают азотистую кислоту действием неорг. к-т на нитриты; .применяют в орг. синтезе для получения солей диазония и др. cоединений.