Азотная кислота, HNO3, одноосновная сильная кислота, при обычных условиях бесцветная жидкость; один из наиболее важных продуктов химической промышленности. Структурная формула:
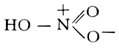
Физические и химические свойства. Плотность безводной А. к. 1522 кг/м3, tпл — 41,15°С, tкип 84° С. С водой смешивается во всех отношениях, причём образует азеотропную смесь, содержащую 69,2% А. к. с tкип 121,8°C. Известны кристаллогидраты HNO3×H2O с tпл —37,85° С и HNO3×3H2O c tпл —18,5°С. В отсутствии воды А. к. неустойчива, разлагается на свету с выделением кислорода уже при обычных температурах (4HNO3 = 4NO2 + 2H2O + O2), причём выделяющейся двуокисью азота окрашивается в жёлтый, а при высоких концентрациях NO2 — в красный цвет. А. к. — сильный окислитель, окисляет серу до серной кислоты, фосфор — до фосфорной кислоты. Только золото, тантал и некоторые платиновые металлы не реагируют с А. к. С большинством металлов А. к. взаимодействует преимущественно с выделением окислов азота: ЗСu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O. Некоторые металлы, например железо, хром, алюминий, легко растворяющиеся в разбавленной А. к., устойчивы к воздействию концентрированной А. к., что объясняется образованием на поверхности металла защитного слоя окисла. Такая особенность позволяет хранить и перевозить концентрированную А. к. в стальных ёмкостях. Смесь концентрированной А. к. и соляной кислоты (1:3), называется царской водкой, растворяет даже золото и платину. Органические соединения под действием А. к. окисляются или нитруются, причём в последнем случае остаток А. к. — нитрогруппа — NO2+замещает в органических соединениях водород. Соли А. к. называютя нитратами, а соли с Na,K, Са, NO4+ также селитрами.
Получение и применение. В 13 в. было описано получение А. к. нагреванием калиевой селитры с квасцами, железным купоросом и глиной. В середине 17 в. И. Р. Глаубер предложил получать А. к. при умеренном (до 150°C) нагревании калиевой селитры с концентрированной серной кислотой: KNO3 + H2SO4 = HNO3 + KHSO4 До начала 20 в. этот способ применяли в промышленности, заменяя калиевую селитру более дешёвой природной чилийской селитрой NaNO3.
Современный способ производства А. к. основан на каталитическом окислении аммиака кислородом воздуха. Основные стадии процесса: контактное окисление аммиака до окиси азота: 4NH3 + 5O2 = 4NO + 6H2O; окисление окиси азота до двуокиси и поглощение смеси так называемых "нитрозных газов" водой: 2NO + O2 = 2NO2; 3NO2 + H2O = 2HNO3+NO. Смесь аммиака (10 — 12% ) с воздухом пропускают через нагретую до 750 — 900° С сетку катализатора, которым служат сплавы платины — тройной (93% Pt, 3% Rh, 4% Pd) или двойной (90 — 95% Pt, 10 — 5% Rh). Используют также двухступенчатый катализатор (1-я ступень — платиноидная сетка, 2-я — неплатиновый катализатор), что позволяет на 25 — 30% сократить расход платины. Время контакта воздушно-аммиачной смеси с катализатором не должно превышать 1 мсек, иначе образовавшаяся окись азота разлагается. Вторая стадия процесса — окисление NO до N02 и растворение NO2 в воде — может быть проведена при атмосферном давлении, под давлением до 1 Мн/м2 (10 кгс/см2) или комбинированным способом, при котором под давлением происходит только поглощение нитрозных газов водой. Получают А. к. с концентрациями 45 — 49% или (при использовании давления) 55 — 58% . Дистилляцией таких растворов может быть получена А. к. азеотропного состава. Более концентрированную кислоту (до 100% ) получают перегонкой растворов А.к. с концентрированной H2SO4 или прямым синтезом — взаимодействием N2O4 с водой (или разбавленной А. к.) и кислородом: 2N2O4 + 2H2O + O2 = =4HNO3. В СССР производят 97 — 98%-ную А. к.
Важнейшие области применения А. к. — производство азотных и комбинированных удобрений, взрывчатых веществ (тринитротолуола и др.), органических красителей. В органическом синтезе широко применяют смесь концентрированной А. к. и серной кислоты — "нитрующую смесь". А. к. используют в камерном способе производства серной кислоты, для получения фосфорной кислоты из фосфора, как окислитель ракетного топлива. В металлургии А. к. применяют для травления и растворения металлов, а также для разделения золота и серебра.
Вдыхание паров А. к. приводит к отравлению, попадание А. к. (особенно концентрированной) на кожу вызывает ожоги. Предельно допустимое содержание А. к. в воздухе промышленных помещений равно 50 мг/м3 в пересчёте на N2O5.Концентрированная А. к. при соприкосновении с органическими веществами вызывает пожары и взрывы.
Лит.: Атрощенко В. И., Каргин С. И., Технология азотной кислоты, М. — Л., 1949; Миниович М. А., О современном состоянии и о перспективах развития производства разбавленной азотной кислоты, "Журнал прикладной химии", 1958, т. 31, в. 8; Миниович М. А., Азотная кислота, КХЭ, т. 1, М., 1961, с. 74-79.
АЗОТНАЯ КИСЛОТА, одноосновная кислота; дымящая на воздухе жидкость. В чистом состоянии бесцветна, по обычно окрашена в жёлтый цвет вследствие частичного разложения под действием спета с образованием двуокиси азота N02. Имеет характерный запах, обжигает кожу, оставляя на ней жёлтые пятна; ядовита.
Историческая справка. А. к. была известна уже алхимикам под названием «крепкая водка». В 8 в. Джабир ибн Гайап (Гебер) описал её приготовление перегонкой квасцов и купороса с селитрой. В 13 —14 вн. А. к. применялась для разделения золота и серебра. В 1650 Глаубер предложил получать А. к. действием концентрированной серной кислоты на калиевую селитру. Однако вследствие дороговизны серной кислоты в 18 в. получали А. к. перегонкой железного купороса с селитрой, как это описывает М. В. Ломоносов в «Первых основаниях металлургии» (1763).
В первой половине 19 в. в связи с развитием основной химической промышленности, удешевлением производства серной кислоты н началом экенлоатации залежей чилийской селитры стало экономически выгодно производство А. к., которое тогда впервые получило промышленный характер; А. к. получали действием серной кислоты на селитру: Ма!Ч03 + Н2801= nMOa-f-iNaHS()4. Этот способ оставался единственным промышленным способом в течение всего 19 в.
К концу 19 в. А. к. получила широкое применение в производстве взрывчатых веществ, красителей и т. д., по её нроизподство оставалось в полной зависимости от единственного источника сырья — чилийской селитры. В настоящее время основным источником получения А. к. является аммиак, получаемый из азота воздуха и водорода. Ещё в 1804 русский учёный В. В. Петров показал, что при пропускании электрнч. разрядов через воздух образуется окись азота. По только с 1903 началось техническое получение окиси азота по способу норвежских учёных К. Биркелаида и С. Эйде путём продувания воздуха через электрпч. дугу. При этом азот окисляется до окиси азота: N, + Oa = 2N0; окись азота, присоединяя кислород воздуха, превращается в двуокись азота: 2INO-j-Oa=2N02, к-рая с водой даёт окись азота и А. к.: ЗМО2-г-П20 — ==NO + 2HN03.
Наилучшая конструкция печей для получения окиси азота была разработана в 1907 русскими учёными А. И. Горбовым и В. Ф. Миткевичем. Однако вскоре этот сиособ получения А. к. был вытеснен другим, гораздо более экономичным, основанным на окислении аммиака. Уже в начале 19 в. было известно, что аммиак можно окислять до окиси азота: 4NII3-(-502=4.NO+6ll20 и превратить окись азота в А." к. по реакциям, написанным выше. Условия окисления аммиака всесторонне изучил и технически разработал в 1915—17 русский инженер И. И. Андреев. В 1917 была закопчена постройка близ Юзивки самою крупного к миро и технчески совершенного для того времени завода но получению А. к. из аммиака. В качестве исходного сырья применялся аммиак, получаемый при коксовании углей, а в качестве катализатора — платина. Россия оказала техническую помощь своим союзникам по первой мировой войне; Франции и Англии были сообщены все данные, и там было поставлено окисление аммиака для получения А. к. о методу Андреева. Этот способ стал в настоящее время единственным в технике.
Физические и х и м и ч е с к и е свойства. При 15° плотность А. к. равна 1,5217, t° пл.—41,2°, t°Kim. 86° при атмосферном давлении. Теплота образования жидкой А. к. из элементов равна 41.600 кал/моль, теплота плавления 601 кал/моль, теплота испарения 7.250 кал/моль. Безводная А. к. при нагревании начинает разлагаться даже ниже тсмп-ры кипения; разложение становится значительным уже при 75°, частичное разлоягеиие А. к. почти всегда имеет место вследствие попадания ныли и незначительного нагрева. Критическая температура недостижима, так как А. к. при 256° распадается нацело. Под влиянием света такяге происходит разложение А. к. с образованием двуокиси азота, кислорода и воды (N02, 02 и Н20). А. к. растворяется в воде в любых отношениях. На диаграмме состав — температура начала кристаллизации системы вода — азотная кислота наблюдаются два максимума: 1) при —18,3°, отвечающий тригидрату HN03-3H20, и 2) при —36,8°, отвечающий гидрату HNO^H20. Самую низкую температуру замерзания (—66,3°) имеет 88,95%-ный раствор А. к. С водой А. к. образует неразделыюкипящую смесь (см. Азеотропные смеси), содержащую при давлении 760 мм ртутного столба 68,4% HN03, t° кип. 121,9°, плотность 1,41. А. к. начинает испаряться уже при 20°; при перегонке вначале отгоняется вода, а но достижении в растворе А. к. ок. 70% перегоняется нераздельно-кипящая смесь. А. к.— сильная кислота, в разбавленных водных растворах она нацело распадается на ионы Н+ и NO~3. А. к. является сильнейшим окислителем: она окисляет большинство металлов. Нек-рые чистые металлы (алюминий, железо, хром) бурно реагируют с разбавленной А. к., но практически не взаимодействуют с концентрированной (см. Пассивность). Концентрированная А. к. весьма энергично действует на многие неметаллы: сера окисляется ею в серную кислоту, фосфор — в фосфорную кислоту и т. д. А. к. разрушает многие органические вещества (в частности животные и растительные ткани). Иногда при окислении концентрированной (дымящей) А. к. выделяется так много теплоты, что окисляемое вещество воспламеняется. Смесь 1 объёма А. к. иЗ объёмов соляной кислоты называется царской водкой (см.); она растворяет золото и платину, переводя их в хлористые соединения. А. к. взаимодействует со многими органическими соединениями; при этом один или несколько атомов водорода в них замещаются нитрогруппой (1Ч02). Эта реакция, известная под названием нитрования (см.), имеет исключительное значение в лабораторных исследованиях и особенно в технологии органических веществ. С её помощью получают взрывчатые вещества, полупродукты для красителей, различные продукты для производства пластических масс, искусственного волокна и т. д. При нитровании, помимо А. к., важными составными частями нитрующей смеси являются серная кислота и четырёхокись азота.
Получение. А. к. в лабораторных условиях может быть получена действием серной кислоты на соли А. к. при осторожном нагревании.
Промышленное получение А. к. основано па окислении аммиака, которое распадается на следующие этапы: 1) окисление (конверсия) аммиака до NO; 2) окисление NO до NO.,; 3) поглощение NO, водой с образованием разбавленной HN03; 4) поглощение хвостовых газов; 5) концентрирование разбавленной (слабой) А. к.
Из газообразного аммиака и воздуха приготовляют смесь, содержащую 10,5—11,2%, а иногда и 12% аммиака и примерно вдвое (1,75—1,80) больше кислорода, чем необходимо для окисления аммиака NO до Н20. Воздух и аммиак тщательно очищают от вредных примесей (фосфористого водорода,сероводорода, масел, окалины, пыли и т. п., которые отравляют катализатор). Воздух предварительно подогревают до 250—300°, затем смешивают в смесителе с аммиаком и смесь газов через смеситель подают в контактный аппарат, обычно состоящий из двух конусов, соединённых между собой основаниями, диаметром 1,1—2 м. В месте соединения конусов расположен катализатор, представляющий собой сетку из платино-родиевой проволоки (содержащей 5— 7%„родия), диаметром 0,05—0,09 мм; число отверстий на 1 см2 сетки равно 1.024 при толщине проволоки 0,09 мм. Потеря платины в производственных условиях достигает 0,20—0,23 г на 1 те 100%-ной азотной кислоты при работе системы под давлением 7—8 атм. и 0,05—0,07 г нри работе с атмосферным давлением. В системах, работающих под атмосферным давлением, катализатор (сетку) располагают обычно в 3 слоя, а в системах с повышенным давлением — в 16—20 слоёв. Активность платиновых сеток с течением времени в процессе работы падает; для восстановления активности сетки её промывают 10—15%-ной соляной кислотой, дестиллиро-ванной водой и прокаливают в водородном пламени.
Сплавы на основе плагины пока остаются лучшими катализаторами для окисления аммиака; наибольшие выходы окислов азота (95—97%) получаются именно на этих катализаторах. Разработанный советскими специалистами сплав даёт выходы на 1,5—2% выше.
Окисление аммиака кислородом сопровождается выделением большого количества тепла: 4NH„+ +5O2==4NO+6H2O-f-216.640 кал. Поэтому в контактных аппаратах развивается высокая температура; в аппаратах, работающих без давления, поддерживается температура 700—750°, а в аппаратах с давлением — 850—900°. При этих температурах скорость реакции весьма; велика.
Советскими учёными детально изучено влияние кислорода па процесс окисления аммиака в окись азота. При наличии дешёвого кислорода применение его приводит к интенсификации процесса, уменьшению объёмов аппаратуры, к получению более концентрированной А. к.
Существует три способа производства А. к.: с применением давления, без применения давления и комбинированный. Применение давлепия в стадии окисления аммиака не даёт никаких преимуществ и даже создаёт дополнительные трудности и расходы. Но оно очень важно при окислении N0 в N02 и отчасти при поглощении окислов азота водой. Так как выходящие из контактного аппарата газы весьма агрессивны и разъедают аппаратуру, в особенности сложную (компрессоры), то такое оборудование предпочитают ставить перед контактными аппаратами; таким образом, вся система работает под давлением. При комбинированном способе окисление аммиака ведут без применения давления, а окисление окиси азота и абсорбцию — под давлением.
Вышедшие из контактного аппарата газы охлаждаются сначала в котле — утилизаторе тепла, а затем в теплообменнике, в к-ром подогревается воздух, идущий затем в смеситель. Из теплообменника газы направляются в холодильник и сепаратор, а затем уже в абсорбционную колонну, где и происходит окончательное поглощение нитрозных газов. Колонна изготовляется из хромоникелевой стали. Во время охлаждения газовой смеси после контактпого аппарата происходит окисление окиси азота: 2N0+ + 0Z = 2N02 за счёт кислорода воздуха; последний дополнительно подаётся в колонну или в холодильник-конденсатор. Поглощение окислов азота водой с образованием А. к. достигает 92—97% от образовавшейся в контактном аппарате N0. Так называемые хвостовые газы, в к-рых содержится еще некоторое количество N0 и N02, поглощаются раствором соды или известковым молоком. В аппаратах под атмосферным давлением получают А. к. с концентрацией 45—50%, под давлением 7—8 атм. — 55—60%.
Концентрированную А. к. получают перегонкой её в присутствии концентрированной серной кислоты; этим способом получается 96—98%-ная А. к. Другой способ получения концентрированной А. к. основан на взаимодействии жидкой четырёхокиси азота N204 с водой (слабой А. к.) в присутствии кислорода под давлением 50 атм. Концентрированная А. к. хранится и перевозится в алюминиевой таре, разбавленная — в таре из специальной стали, а небольшие количества — в керамической и стеклянной посуде.
Применение. А. к. имеют очень широкое применение. Огромное количество её идёт на приготовление азотных удобрений, различных солей, взрывчатых веществ (необходимых не только для военных, но и мирных целей), для производства органических нитропродуктов, идущих на приготовление красителей, лекарственных препаратов, для производства нитроцеллюлозы, искусственного шёлка; применяется А. к. также как окислитель во многих химич. производствах и как реактив в химич. лабораториях и т. д.
Лит.: Лукьянов П.М., История химических промыслов и химической промышленности России до концаХ1Х века, т. 2, М.— Л-, 1949; Сапожников А., Азотная кислота и селитра из воздуха, «Журнал Русского физико-химического общества», 1911, т. 43, вып. 3; Андреев И. И., Исследования в области азотных соединений, П., 1921 (Труды Комиссии по связанному азоту при ВСНХ, вып. 7); Колосов А. К., Контактное производство азотной кислоты. История постройки и эксплоатации первого русского азотного завода, П., 1923 (Труды Комиссии по связанному азоту при ВСНХ, вып. 9); Э п ш т е й н Д.А., Синтетическая азотная кислота, М.— Л-, 1933; Общая химическая технология под ред. С. И. Вольфковича, т. 1, М., 1940; Атрощенко В. И. и К а р г и н С. И., Технология азотной кислоты, М.— Л-, 1949.
